Pendant le déroulé de la recherche
Attention : Information par le promoteur sans délai à l'ANSM et au CPP du commencement de la recherche
Date de la première inclusion (signature du premier consentement de participation)
Notification des modifications substantielles : demande d'autorisation à l'ANSMet/ou d'avis au CPP
Modification substantielle:
Modification survenant après le commencement de la recherche, ayant un impact significatif sur tout aspect de la recherche, notamment sur la protection des personnes, y compris à l'égard de leur sécurité, sur les conditions de validité de la recherche, le cas échéant, sur la qualité et la sécurité des médicaments expérimentaux, sur l'interprétation des documents scientifiques qui viennent appuyer le déroulement de la recherche ou sur les modalités de conduite de celle-ci
Les modifications non substantielles (celles qui n'ont pas d'impact significatif sur quelque aspect de la recherche que ce soit) ne sont pas à soumettre à l'Afssaps ni pour autorisation ni pour information
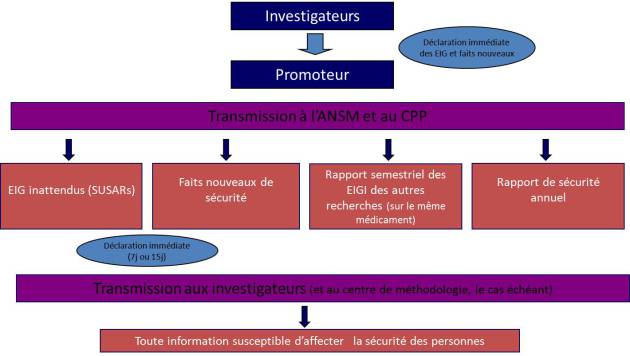
La vérification de la notification des événements indésirables et du respect des délais
Définition : Evènement indésirable
Toute manifestation nocive survenant chez une personne qui se prête à une recherche biomédicale, que cette manifestation soit liée ou non à la recherche ou au produit sur lequel porte cette recherche
Définition : Evènement indésirable
Toute réaction nocive et non désirée liée à la recherche ou au produit sur lequel porte la recherche
Définition : Evènement ou effet indésirable grave
Tout événement ou effet indésirable qui :
entraîne la mort,
met en danger la vie de la personne qui se prête à la recherche,
nécessite une hospitalisation ou la prolongation de l'hospitalisation,
provoque une incapacité ou un handicap importants ou durables,
ou bien se traduit par une anomalie ou une malformation congénitale,
et s'agissant du médicament, quelle que soit la dose administrée
Définition : Effet indésirable inattendu
Tout effet indésirable du produit dont la nature, la sévérité ou l'évolution ne concorde pas avec les informations figurant dans les dossiers de demande d'avis au CPP et de demande d'autorisation à l'autorité compétente
Définition : Fait nouveau
Nouvelle donnée de sécurité, pouvant conduire à une réévaluation du rapport des bénéfices et des risques de la recherche, ou qui pourrait être suffisant pour envisager des modifications des documents relatifs à la recherche, de la conduite de la recherche ainsi que, le cas échéant, dans l'utilisation du produit